XP S99-223 : Medical Device – Benefit / Risk management : preview
Mise à jour du guide et du support HAS des dépôts de dossiers LPPR
DARE!! Services B.V. est notifié pour le règlement DM
ON-o-meter : suivi des notifications pour le règlement 2017/745
BSI Group The Netherlands B.V. est notifié pour le règlement DM
Cybersécurité des dispositifs médicaux
[Infographie] Les normes pour les Dispositifs Médicaux
Notifications DARE!! et BSI NL –Évaluation clinique – Cybersécurité – Docteur Google
Ministère de la Santé : Identification individuelle des DM – Update des dates d’entrée en vigueur du décret 2019-571
Mise à jour du Guide LPPR
Ministère de la Santé : Nouveaux codes individuels LPP
Nouveau Portail MedimedDM et dématérialisation partielle des dossiers de prix LPP
Tech Santé, épisode II : podcast sur l’utilisation de la Tech en Santé [sommaire]
Mise à jour du guide lié à l’évaluation clinique : définitions et concepts clés
L’IMDRF a mis à jour son guide lié à l’évaluation clinique et ses définitions et concepts clés. Il s’agit d’une mise à jour ayant pour base la version de 2007 (GHTF/SG5/N1R8:2007) qui était encore sous format GHTF, l’ancêtre de l’IMDRF.
Modifications
Une première modification tient dans la prise en compte, au sein des définitions et concepts clés, des dispositifs médicaux de diagnostic in vitro. Ces derniers voient ainsi le principe de l’évaluation des performances intégré au guide, en accord avec la définition du RDM 2017/746.
La définition de donnée clinique évolue également, avec l’ajout d’une nouvelle source de donnée clinique : les données provenant des registres, bases de données de vigilance ou encore des dossiers médicaux.
Enfin, la définition d’évaluation clinique évolue légèrement en intégrant la nécessité que cette démarche soit en accord avec une méthodologie scientifique.
- Source : IMDRF
- Auteur : Arnaud Seyller
Guide pour l’évaluation clinique : Revue des modifications
L’IMDRF a mis à jour son guide pour l’évaluation clinique des dispositifs médicaux. Il s’agit d’une mise à jour ayant pour base la version de 2007 (GHTF/SG5/N2R8:2007) qui était encore sous format GHTF, l’ancêtre de l’IMDRF.
Revue des modifications du guide
Une première modification tient dans la prise en compte des dispositifs médicaux de diagnostic in vitro avec l’intégration de l’évaluation des performances. Un paragraphe spécifique est également ajouté, présentant les références des autres guides GHTF/IMDRF à considérer sur les DMDIV.
Au sein du guide, plusieurs définitions du guide sont amendées, supprimées ou ajoutées en tenant compte des autres guides et travaux de l’IMDRF.
Une clarification du paragraphe lié à l’équivalence entre dispositifs médicaux a été apportée. L’ancien guide GHTF demandait notamment une utilisation prévue identique des deux dispositifs médicaux là où le nouveau guide apporte un peu de souplesse, demandant une similarité.
Les logiciels considérés comme dispositifs médicaux font leur apparition, confirmant qu’ils doivent avoir une évaluation clinique et qu’un guide spécifique a été rédigé sur ce sujet : “Software as a Medical Device (SaMD): Clinical Evaluation SaMD WG/N41:2017”
La section sur les sources de données cliniques a également été mise à jour, en ajoutant les dossiers médicaux comme source possible ainsi que les registres, notamment ceux entrant dans le champ de la définition de l’IMDRF.
Les documents liés aux conflits et déclarations d’intérêts, liens et accords financiers créés à l’occasion des investigations cliniques sont maintenant à considérer au sein des évaluations cliniques utilisant les données cliniques générées par ces mêmes investigations.
De même, il est maintenant exigé de démontrer que les données cliniques collectées lors d’investigation clinique dans d’autres territoires l’ont été légalement, en accord avec les exigences du pays où le dispositif sera mis à disposition, et que les données cliniques générées dans ces autres territoires ne peuvent pas influencer la qualité des données, prenant en compte les variabilités induites par des facteurs intrinsèques (génétique, âge, genre, …) ou des facteurs extrinsèques (pratique clinique, environnement, …)
Enfin, la conclusion de l’évaluation clinique doit maintenant également porter sur la conformité aux exigences générales ainsi que statuer sur un besoin en donnée clinique complémentaire.
Des nouveautés également côté annexes
Deux nouvelles annexes :
- Une nouvelle annexe A proposant des précisions sur la démonstration d’équivalence entre dispositifs médicaux, similaire à ce que l’on retrouve dans le MEDDEV 2.7/1 rev 4.
- Une nouvelle annexe D détaillant les modalités d’évaluation des données cliniques issues d’investigation clinique réalisée dans d’autres territoires.
- Source : IMDRF
- Auteur : Arnaud Seyller
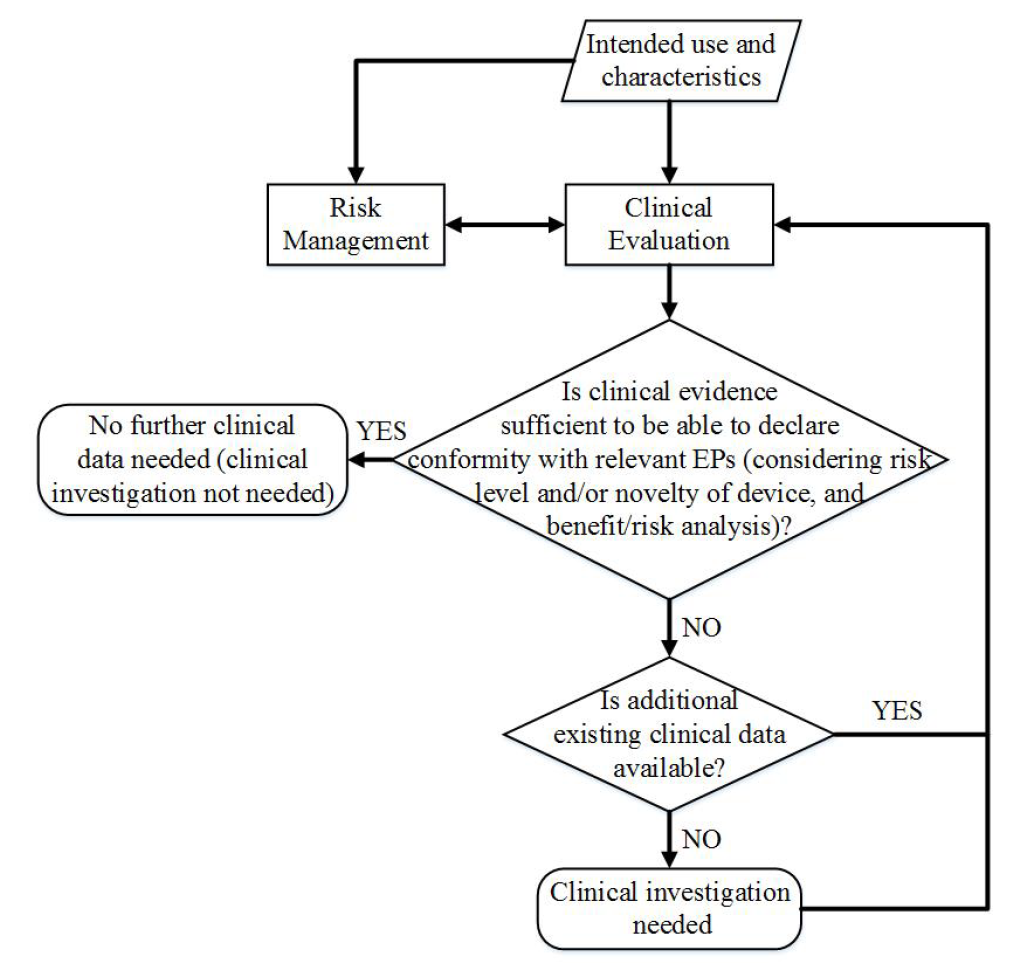
Guide pour l’investigation clinique : Revue des modifications
L’IMDRF a mis à jour son guide lié à l’investigation clinique. Il s’agit d’une mise à jour ayant pour base la version de 2010 (GHTF/SG5/N3:2010) qui était encore sous format GHTF, l’ancêtre de l’IMDRF.
Revue des modifications
Outre la prise en considération de la version la plus récente de la norme ISO 14155:2019, le guide prend en compte les nouvelles définitions ainsi que les nouveaux travaux et guides publiés par l’IMDRF.
Les fabricants doivent maintenant considérer le besoin de lancer de nouvelles investigations cliniques à la lumière de nouvelles questions de sécurité ou performance clinique liées à leurs dispositifs médicaux, notion qui était absente de la précédente version.
Le guide présente maintenant le besoin d’évaluer de le rapport bénéfice/risque comme facteur à considérer avant le lancement d’une investigation clinique. Ce questionnement est repris dans le logigramme suivant :
Les données nécessaires pour l’établissement du protocole d’investigation clinique ont également été mises à jour, avec l’ajout d’exigence telles que les procédures prévues pour la gestion des abandons ou de données manquantes …
Il est également maintenant suggéré de prendre en compte les courbes d’apprentissage anticipées des utilisateurs dans les protocoles.
Il est également précisé que les investigations cliniques multirégionales sont réputées pouvoir garantir un accès précoce aux différents marchés, ce qui ne surprendra personne.
- Source : IMDRF
- Auteur : Arnaud Seyller
Mise à jour du Guide intra-GHS
La HAS vient d’actualiser son guide intra-GHS destiné aux dispositifs médicaux à usage individuel qui sont utilisés en établissement de santé et qui sont financés au travers des prestations hospitalières par une enveloppe globale au titre des Groupes Homogènes de Séjour (intra-GHS).
Ce guide a pour but d’aider les demandeurs à constituer un dossier :
- de demande d’inscription,
- de modification des conditions d’inscription et
- de renouvellement d’inscription d‘un produit sous nom de marque sur la liste prévue à l’article L. 165-11 du code de la sécurité sociale (CSS) dite « liste intra-GHS ».
Il détaille les éléments à fournir pour permettre l’instruction du dossier et son examen par la Commission nationale d’évaluation des dispositifs médicaux et des technologies de santé (CNEDiMTS).
Même si toujours le document est toujours en 2014 dans le titre du document, nous avons bien eu une MAJ de novembre (ce guide est régulièrement mis à jour ainsi que la matrice word associé).
Pas de modification majeure de ce guide, mais on trouve des nouvelles précisions telles que la définition de Télésoin qui a été voté cet été :
« Le télésoin est une forme de pratique de soins à distance utilisant les technologies de l’information et de la communication. Il met en rapport un patient avec un ou plusieurs pharmaciens ou auxiliaires médicaux dans l’exercice de leurs compétences prévues […] »
Est également apparue la plateforme SESAME, pour soumettre numériquement ces dossiers à la HAS.
Pour rappel, le dossier à déposer se compose comme suit :
Partie 1 – synthèse et identification de la demande :
- lettres de demande
- déclaration de conformité et certification CE
- certificat(s) CE délivré(s) par un organisme notifié
- pour les DM connectés : déclaration de conformité aux exigences du RGPD et le certificat de conformité de l’hébergeur
- pour les aliments diététiques/denrées alimentaires : notification à la DGCCRF et avis de l’ANSES. Pour les allogreffes : autorisation unique délivrée par l’ANSM
- notice d’instruction en français portant le marquage CE
- attestations de conformité en vue de la prise en charge par inscription sur la LPPR
- Ces éléments seront déposés sous forme d’un document unique au format PDF exploitable.
Partie 2 – dossier médico-technique
- dossier médico-technique
- résumés tabulés en français des données scientifiques de l’annexe I
- tableau de synthèse des données de matériovigilance
- dossier médico-technique doit obligatoirement être déposé sous forme d’un document unique, paginé, en format Word.
Annexe I – données scientifiques
- sommaire
- partie Etudes spécifiques soutenant l’argumentaire : résumé tabulé et publication ou, pour les études non publiées, protocole & rapport d’étude
- partie Etudes NON spécifiques soutenant l’argumentaire : résumé tabulé et publication ou, pour les études non publiées, protocole & rapport d’étude
- listes et références des documents généraux joints à la demande en annexe II (le sommaire de l’annexe II)
- l’annexe I doit être déposée sous forme d’un document unique, paginé, en format PDF.
Annexe II – documents généraux à joindre à la demande
- comporte les autres données à ajouter lors de la demande : les recommandations professionnelles ou autres rapports ou publications cités dans le dossier (ne faisant pas l’objet d’un résumé tabulé), les éventuels avis antérieurs de la CNEDiMTS et les arrêtés parus au Journal officiel ainsi que les lettres de demande de radiation.
- l’annexe II doit être déposée sous forme d’un document unique, paginé, en format PDF.
Le dépôt des dossiers auprès de la CNEDiMTS se fait uniquement en ligne via la plateforme SESAME, en vigueur depuis le 2 avril 2019.
Source : HAS : Guide Intra-GHS pour le dépôt de dossier (actualisation nov. 2019)
Rumeurs: retards et nouvel ON FR ? • MEDICA 2019 • Apple Heart study : les résultats !
Envoyé spécialitiso
- 🙂 Mathieu Charleux en direct de Médica 2019 !
L’actu du DM
- 🙂 Allemagne : Les médecins devraient pouvoir prescrire des applications
- Apple :
- 😄 Apple : les résultats de l’étude clinique “Apple Heart Study”,
- 😠 Mini-Quash investiso : le blocage de sci-hub
- 🤔 Apple annonce trois études de santé inédites
- Bio impression :
- 🙂 La bio-impression, futur de la médecine sur-mesure ?
- 🙂 Une équipe de scientifiques bio-imprime en 3D de la peau vascularisée
- 💡 L’impact et le potentiel de l’impression 3D et de la bio-impression dans l’industrie des dispositifs médicaux, selon BSI
- IA :
- 😐(B) L’intelligence artificielle pour remplacer la contraception
- 🤔 Une IA pour prédire si vous allez décéder dans l’année
- 🙂 (B) Injectable, flexible electrode could replace rigid nerve-stimulating implants
L’actu du RAQ
Europe
- 😠 Point Notifications : – de 10 pour 2019, le DEMG d’ici 3 à 6 mois, un nouvel ON français ? moins de 100 certificats MDR délivrés par le BSI avant mai 2020 !
- 😠 Mise à jour des tarifs du BSI
- 😠 EU Regulatory Roundup: Health Group Raises Concerns About Delays to Clinical Trial Portal and Database
France
- 💡 HAS : Projet de grille d’analyse pour l’évaluation des intelligences artificielles DM
- 🤔 Les désinfectants Surfa’safe premium et Opaster Anios ne doivent plus être utilisés, rupture à venir
Normes
- 😐 Les amendements (sur les annexes Z) des normes en enquête publique :
- 💡 DM – Application de la gestion des risques : IEC 80001-1 en enquête publique
Bonus
- 🙂 BirdLab : Un jeu pour observer les oiseaux à la mangeoire
- 💡😄 Les possédés
Bonus bonus
- Nouvelles interfaces podcasts Qualitiso et Tech Santé.
Participants
BlogRoll
Projet de notice pour l’évaluation de dispositifs médicaux avec intelligence artificielle
La HAS vient de publier un projet de notice pour l’évaluation des dispositifs médicaux ayant recours à une IA, par le CNEDIMTs, dans le cadre d’une demande de remboursement.
Le document est en enquête publique, vous pouvez remonter vos avis.
Grille d’évaluation
La grille d’évaluation proposée est reportée ci-dessous. Notes que c’est avant tout une fiche de renseignement, les différents items sont attendus dans votre documentation technique.
| I. FINALTÉ | |
|---|---|
| 1 | Préciser l’intérêt des informations qui seront fournies par le système en s’appuyant sur des procédés d’apprentissage automatique Par exemple, s’agit-il : • d’aider le patient à adapter la posologie de son traitement ? • d’aider le médecin à établir un diagnostic ou à sélectionner les examens à réaliser ? • de prédire la survenue d’un événement ? |
| 2 | Décrire les caractéristiques de la population visée pour l’indication du DM Celles-ci peuvent être : • démographiques • médicales… |
| II. APPRENTISSAGE | |
| 3 | Préciser le type d’apprentissage Est- il : • continu (algorithme autoapprenant) ? • initial (algorithme conçu par apprentissage puis non évolutif) ? • ou incrémental (algorithme dont la structure et/ou les paramètres sont mis à jour par apprentissage) ? |
| 4 | Décrire le ype de modèle utilisé S’agit-il d’un apprentissage automatique : • supervisé ? • semi-supervisé ? • non supervisé ? • par renforcement ? |
| 5 | Décrire le type d’algorithme utilisé • classification • régression • clustering |
| 6 | Décrire la méthode de sélection du modèle Par exemple, à partir de modèles testés ou du fait de la priorité donnée à l’interprétabilité de la méthode |
| 7 | Décrire les différentes phases d’apprentissage et de contrôle Indiquer spécifiquement celles s’appuyant sur un apprentissage à partir de données individuelles ou collectives. |
| 8 | Décrire les stratégies de réentrainement Par exemple, la fréquence de réentrainement, les variables impliquées et la période de prise en compte des données |
| 9 | Indiquer, le cas échéant, dans quels cas un humain intervient dans le processus de réapprentissage Par exemple, en cas d’apprentissage actif, préciser la fréquence et la qualification de l’intervenant |
| III. DONNEES DE (RE) APPRENTISSAGE | |
| III.1 DESCRIPTION DES ECHANTILLONS DE LA POPULATION UTILISES POUR DEVELOPPER LE MODELE | |
| 10 | Préciser les caractéristiques de chaque échantillon. Sont attendues : leur fonction, leur taille et leur composition. Les variables incluses doivent être citées. La manière dont sont pris en compte les événements rares doit être décrite. |
| 11 | Préciser leurs modalités de constitution ou, le cas échéant, la méthodologie de séparation ou de segmentation Par exemple, préciser les modalités de séparation des jeux de données d’entrainement, de test et de validation |
| 12 | Justifier de la représentativité des échantillons utilisés pour l’apprentissage de l’algorithme par rapport aux échantillons auxquels cet algorithme sera exposé une fois déployé Une justification des critères de représentativité est attendue |
| III.2 DESCRIPTION DES VARIABLES | |
| 13 | Préciser les caractéristiques des variables • type • distribution |
| 14 | Indiquer le mode d’acquisition des variables et leur origine lors du processus d’apprentissage Par exemple, une variable a-t-elle été saisie par un patient ? Provient-elle d’un capteur ? A-t-elle été générée à partir de modèles de patients virtuels ? |
| III.3 DESCRIPTION DES TRAITEMENTS REALISES SUR CES DONNEES EN AMONT DE LEUR UTILISATION DURANT L’APPRENTISSAGE |
|
| 15 | Décrire les tests pratiqués sur les données |
| 16 | Décrire les transformations appliquées aux données Par exemple, les méthodes d’augmentation de données |
| 17 | Décrire la gestion des données manquantes |
| 18 | Expliquer les règles de détection des données aberrantes et décrire la gestion de celles-ci En particulier, comment sont discriminées les données aberrantes des valeurs les moins probables |
| III.4 DONNEES DE DECISION | |
| 19 | Indiquer le mode d’acquisition des variables et leur origine Par exemple, une variable a-t-elle été saisie par un patient ? Provient-elle d’un capteur ? |
| 20 | Préciser les caractéristiques des variables • type • distribution |
| IV. PERFORMANCE | |
| 21 | Décrire et justifier le choix de la métrique c’est-à-dire la méthode de mesure de la performance Par exemple : RMSE, AUC, F1-score… |
| 22 | Décrire les impacts potentiels des traitements opérés Par exemple, en cas de rééquilibrage de classes |
| 23 | Caractériser le sur et le sous apprentissage |
| 24 | Décrire les méthodes de gestion du sur et du sous apprentissage |
| V. VALIDATION | |
| 25 | Décrire les méthodes de validation |
| 26 | Rapporter les performances sur les différents jeux de données Par exemple, les résultats des bases de tests et validations, selon la répartition réalisée |
| VI. RESILIANCE | |
| 27 | Décrire les mécanismes mis en place pour mesurer la dérive du modèle |
| 28 | Préciser les seuils choisis (valeurs limites, taux d’erreur maximal…) |
| 29 | Préciser s’il y a un système de détection d’anomalie des données d’entrée impliquées dans la décision |
| 30 | Décrire les impacts potentiels dus à ces données d’entrée Par exemple : • En cas de non correction des valeurs aberrantes • En cas de d’utilisation de valeur déclaratives • Du fait du niveau d’incertitude associé aux données d’entrée (données physiologiques, environnementales…) |
| 31 | Préciser les mesures mises en place en cas de dérive du modèle ou des données d’entrée Par exemple : mode dégradé, substitution de l’algorithme apprenant par un système expert… |
| 32 | Décrire les situations identifiées comme étant susceptibles d’altérer fonctionnement du système |
| VII. EXPLICABILITÉ / INTERPRÉTABILITÉ | |
| 33 | Indiquer si l’algorithme peut bénéficier d’une technique d’explicabilité / interprétabilité En particulier, pour les algorithmes autoapprenants, une technique d’explicabilité est-elle applicable pour permettre au clinicien ou au patient de comprendre les principaux facteurs ayant conduit à la décision prise ou proposée ? |
| 34 | Indiquer les éléments d’explicabilité mis à disposition Par exemple, indiquer si l’explicabilité de la prise de décision est enregistrée pour analyse a posteriori par des experts en cas de dérive du modèle |
| 35 | Identifier les paramètres influents Pour les algorithmes ayant eu un apprentissage initial ou incrémental, ces paramètres sont-ils identifiés et sont-ils en cohérence avec les connaissances scientifiques ? |
| 36 | Préciser si le mode d’action du système est cohérent Par exemple, le processus décisionnel est-il en accord avec les recommandations professionnelles, lorsqu’elles existent ? |
source : HAS
Enquête publique : IEC 80001-1 Gestion des risques des DM connectés
La norme EC 80001-1 est disponible en enquête publique, elle concerne la santé IT, il vous est possible de répondre jusqu’au 10 janvier 2020.
Scope
La norme spécifie un cadre pour l’application de la gestion des risques avant, pendant et après la connexion d’un système IT de santé au sein d’une infrastructure IT de santé.
Gestion des risques
la norme reprend les principes de l’ISO 14971, avec des considérations propres aux IT de santé, notamment en matière de prise en compte du contexte organisationnel (qui intervient sur le système IT de santé pendant son cycle de vie).
La gestion du rapport bénéfice / risque est évoquée :
Il est nécessaire que l’analyse prenne également en compte le risque-bénéfice global, c’est-à-dire la somme de tous les risques non acceptés et des bénéfices cliniques nets du déploiement. Si l’analyse ne permet pas de conclure que les bénéfices l’emportent sur le risque résiduel, le risque reste inacceptable.
Notez qu’ici le rapport B/R vaut bien bénéfices / risques résiduels
L’expression : bénéfices cliniques nets du déploiement / risques non acceptés est assez obscure.
Cycle de vie
Des exigences sont associées au cycle de vie des IT de santé, en matière :
- D’acquisition (identification des risques)
- D’Installation, de personnalisation et de configuration des systèmes IT de santé
- D’intégration, de migration de données, de transition et de validation
- De mise en œuvre, d’optimisation du flux de travaux et de formation
- D’exploitation et de maintenance
- De mise hors service
Cas d’assurance
La gestion d’un cas d’assurance est exigée, il faudra :
- L’établir en début de projet
- Y incorporer les données de sortie pertinentes de la gestion des risques
Cette notion est très proche du dossier de gestion des risques, puisqu’elle vise à assurer que le risque résiduel global a été pris en compte dans le contexte du déploiement et de l’utilisation prévue et que l’acceptabilité des risques résiduels est justifiée.
pour information : cet concept est développé dans la norme ISO/IEC 81001
source : norm’info